اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش


16,500 تومانشناسه فایل: 9652
- حجم فایل ورد: 332KB حجم پیدیاف: 280.7KB
- فرمت: فایل Word قابل ویرایش و پرینت (DOCx)
- تعداد صفحات فارسی: 18 انگلیسی: 7
- دانشگاه:
- Environmental Health Science and Research Bureau, Health Canada, Ottawa, Ontario, Canada K1A 0K9
- Nutrition Research Division, Food Directorate, Health Products and Food Branch, Health Canada, Ottawa, Ontario, Canada K1A 0K9
- ژورنال: Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis
مقدمه مقاله
جهش های رگه زایشی ممکن است منجر به نتایج مضر مختلف از جمله مرگ و میر جنینی، بیماری ارثی ژنتیکی یا ناپایداری ژنتیکی درون نسل شود. با توجه به اینکه ژرم لاین فراوانی موتاسیونی خود به خودی زیادی دارد، آزمایش های موتاسیون سلول ژرم، اغلب به تعداد زیادی از حیوانات و دوزهای شیمیایی بالا برای تشکیل عاملی تحت عنوان موتاژنیک نیاز دارد. درنتیجه اطلاعات بسیار کمی در رابطه با متغیرهای محیطی که بر میزان موتاسیون سلول ژرم در مقایسه با سلول های سوماتیکی تاثیر دارد، وجود دارد. تا امروز کمتر از 50 موتاژن در رابطه با توانایی جهش ارثی وجود دارد. شواهد موجود از توانایی موتاژن شدن رگه زایشی توسط عوامل مختلف شامل تشعشع، داروهای موتاژن ضد سرطان و آلودگی های محیطی خاص (دود توتون، آلودگی شهری هوا) حمایت می شود. اگرچه، اطلاعات نسبتاً کمی در رابطه با متغیرهای رژیمی که میزان جهش سلول ژرم تحت تاثیر قرار می دهند، بدست آمده است.
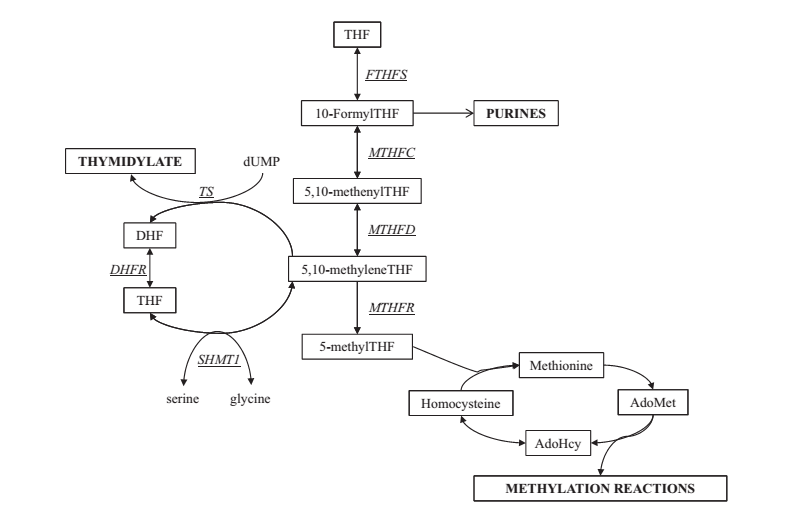
فولات، ویتامین ب ضروری، برای سنتز دنوو پورین ها، تیمیدیلات و متیونین ضروری است. فولات برای حفظ سنتز DNA و متیله شدن و در نهایت ساختار کروماتین و بیان ژن آن ضروری است (شکل 1). در سلولهای سوماتیکی، کمبود فولات می تواند منجر به افزایش الحاق اوراسیل در DNA، شکستگی باندهای دوگانه DNA، ناپایداری ژنومی و هیپو متیلاسیون DNA شود. اگرچه در مطالعات اندکی اثرات کمبود اسید فولیک بر سلول های ژرم بررسی شده است.
کمبود فولات با شاخص های کاهش باروری نر همراه است. برای مثال، فولات کمتر در پلاسمای سمینال با کاهش تعداد اسپرم و افزایش خسارت DNA اسپرم در انسان همبستگی دارد. ارتباط معکوس بین کل مصرف فولات روزانه و فراوانی اسپرم آنئوپلوئید در انسان ها مشاهده شده است. در موش های تیمار شده با متوترکسات، شیموتراپاتیک آنتی فولات، منجر به کاهش تعداد اسپرم و افزایش خسارت به DNA اسپرم میشود (21، 22). این مطالعات نشان داد که فولات بر سلامت اسپرم و تمامیت DNA، تاثیر دارد و پیشنهاد می شود که کمبود فولات ممکن است به عنوان موتاژنیک برای سلول DNA ژرم محسوب شود.
در سال 1998، کشورهای کانادا و ایالات متحده متعهد شدند تا اسید فولیک را در جهت کاهش نقص در سیستم عصبی به آرد سفید اضافه کنند. پروژه تقویت اسید فولیک به طور موفقیت آمیزی، کمبود فولات در کانادا را رفع کرد؛ اگرچه وضعیت فولات از بخش قابل توجهی از جمعیت به طور کلی، نشان دهنده مصرف اسید فولیک در یا بالاتر از سطح مصرف قابل تحمل است. مصرف بالاتر اسید فولیک می تواند متابولیسم را درونسلولی[1] کرده و منجر به حضور اسید فولیک متابولیزه نشده در جریان شود. اسید فولیک در گردش، باید از طریق بافت ها متابولیزه شده و حضور اسید فولیک متابولیزه نشده می تواند منجر به تجمع دیهیدروفولات سلولی، بازدارنده متیلن تتراهیدروفولات ردوکتاز و تیمیدیلات سنتاز شود. بازدارندگی این آنزیم ها پیشنهاد می شود که متیونین و تیمیدیلات سنتاز را کاهش دهد. در نهایت ورودی بالاتر اسید فولیک، به طور متناقضی منجر به نقش در کارایی فولات و در نهایت منجر به افزایش میزان موتاسیون و ناپایداری ژنوم می شود.
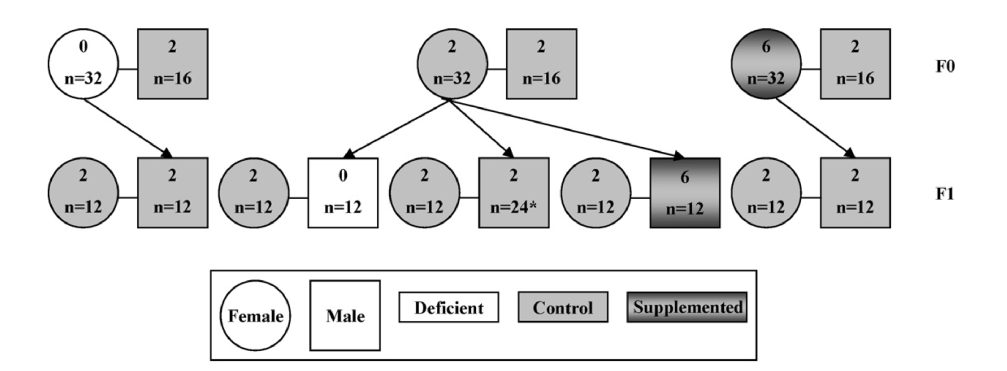
در مطالعه حاضر، اثرات کمبود و تکمیلی اسید فولیک بر تمامیت سلول ژرم نر بررسی می شود. ما سه میزان از اسپرم، شامل تعداد، DNA خسارت دیده با استفاده از آزمایش ساختار کروماتین اسپرم (SCSA) و جهش های توالی DNA، در توالیهای مکرر سیستم تکراری را ارزیابی می کنیم. اثرات اسید فولیک رژیمی در رحم و طی شیردهی (نمو اولیه) یا از مرحله از شیر گرفتگی (15 هفته) مورد ارزیابی قرار گرفت. سه گروه رژیمی شامل کمبود اسید فولیک (صفر میلیگرم بر کیلوگرم)، مصرف روزانه پیشنهادی اسید فولیک (شاهد، 2 میلیگرم بر کیلوگرم) و اسید فولیک تکمیلی (6 میلیگرم بر کیلوگرم) در سه زمان، مصرف روزانه پیشنهادی و نزدیک به مصرف 1 میلیگرم بر روز فولیک اسید تکمیلی و اسید فولیک حاصل از غذاهای غنی شده استفاده شد.
ABSTRACT Investigating the effects of dietary folic acid on sperm count, DNA damage and mutation in Balb/c mice
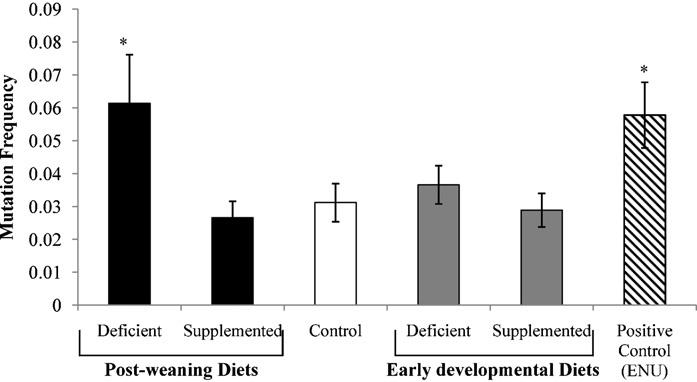
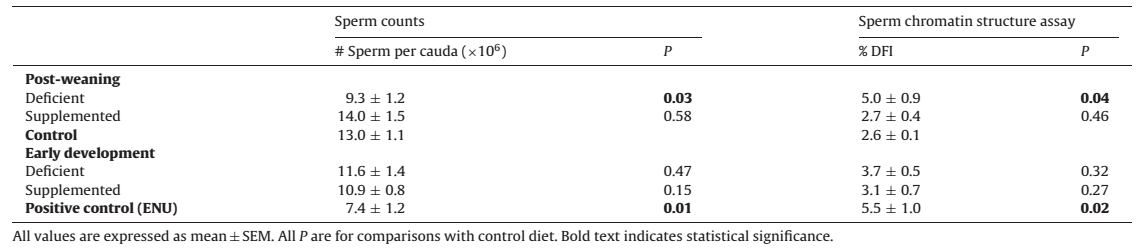
To date, fewer than 50 mutagens have been studied for their ability to cause heritable mutations. The majority of those studied are classical mutagens like radiation and anti-cancer drugs. Very little is known about the dietary variables influencing germline mutation rates. Folate is essential for DNA synthesis and methylation and can impact chromatin structure. We therefore determined the effects of folic acid-deficient (0 mg/kg), control (2 mg/kg) and supplemented (6 mg/kg) diets in early development and during lactation or post-weaning on mutation rates and chromatin quality in sperm of adult male Balb/c mice. The sperm chromatin structure assay and mutation frequencies at expanded simple tandem repeats (ESTRs) were used to evaluate germline DNA integrity. Treatment of a subset of mice fed the control diet with the mutagen ethylnitrosourea (ENU) at 8 weeks of age was included as a positive control. ENU treated mice exhibited decreased cauda sperm counts, increased DNA fragmentation and increased ESTR mutation frequencies relative to non-ENU treated mice fed the control diet. Male mice weaned to the folic acid deficient diet had decreased cauda sperm numbers, increased DNA fragmentation index, and increased ESTR mutation frequency. Folic acid deficiency in early development did not lead to changes in sperm counts or chromatin integrity in adult mice. Folic acid supplementation in early development or post-weaning did not affect germ cell measures. Therefore, adequate folic acid intake in adulthood is important for preventing chromatin damage and mutation in the male germline. Folic acid supplementation at the level achieved in this study does not improve nor is it detrimental to male germline chromatin integrity.
Introduction
Germline mutation may lead to various detrimental outcomes including embryonic lethality, inherited genetic disease or transgenerational genetic instability [1]. Since the germline has a very low spontaneous mutation frequency, germ cell mutation assays generallyrequirelargenumbersofanimalsandhighchemicaldoses to establish an agent as mutagenic [2]. As a result, much less is known about the environmental variables that influence germ cell mutation rates compared to somatic cells. To date, fewer than 50 mutagens have been studied for their ability to cause heritable mutations [3]. Existing evidence supports the germline mutagenicity of various agents including radiation, mutagenic anti-cancer drugs, and specific environmental mixtures (tobacco smoke, urban air pollution) [4–11]. However, relatively little is known about dietary variables that affect germ cell mutation rates.
Folate, an essential B vitamin, is required for the de novo synthesis of purines, thymidylate and methionine [12]. As such, folate is required for the maintenance of DNA synthesis and methylation, and consequently chromatin structure and gene expression (Fig. 1). In somatic cells, folate deficiency can lead to increased uracil incorporation into DNA, DNA double strand breaks, genome instability and DNA hypomethylation [13–17]. However, few studies have examined the effects of folic acid deficiency on germ cells.
Folate deficiency is associated with indicators of reduced male fertility. For example, low folate in seminal plasma is correlated with decreased sperm counts and increased sperm DNA damage in humans [18,19]. An inverse relationship between total daily folate intake and the frequency of aneuploid sperm in humans has also been observed [20]. In mice, treatment with methotrexate, an antifolate chemotherapeutic, leads to decreased sperm counts and increased sperm DNA damage [21,22]. These studies demonstrate that folate impacts sperm health and DNA integrity, suggesting that folate deficiency may be mutagenic to germ cell DNA.
In 1998, Canada and the US mandated fortification of white flour with folic acid to reduce the incidence of neural tube defects [23]. Folic acid fortification has successfully eliminated folate deficiency in Canada; however, the folate status of a significant proportion of the general population is indicative of folic acid intakes at or above the tolerable upper intake level [24,25]. High folic acid intake can overwhelm enterocyte metabolism and result in the presence of unmetabolized folic acid in circulation [26,27]. Circulating folic acid must be metabolized by the tissues and the presence of unmetabolized folic acid could result in the accumulation of cellular dihydrofolate, an inhibitor of methylenetetrahydrofolate reductase [28] and thymidylate synthase [29]. Inhibition of these enzymes has been proposed to decrease methionine and thymidylate synthesis [30]. Consequently, high folic acid intake may, paradoxically, result in a functional folate deficiency, resulting in increased mutation rates and genome instability.
In the present study we explore the effects of folic acid deficiency and supplementation on male germ cell integrity. We evaluated three measures of sperm health including sperm count, DNA damage using the sperm chromatin structure assay (SCSA), and DNA sequence mutations at tandemly repeated sequences. The effects of dietary folic acid in utero and during lactation (early development) or from weaning for 15 weeks were investigated. Three dietary groups representing folic acid deficiency (0 mg/kg), the recommended daily intake of folic acid (control, 2 mg/kg), and folic acid supplementation (6 mg/kg) at three times the daily recommended intake and approximating the consumption of a 1 mg/day folic acid supplement and folic acid from fortified foods were used.

- مقاله درمورد اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- اثرات کمبود و تکمیلی فولیک اسید بر تمامیت سلول ژرم نر
- بررسی اثرات اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش در موش Balb / c
- پروژه دانشجویی اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- بررسی اثرات اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- پایان نامه در مورد اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- تحقیق درباره اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- مقاله دانشجویی اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش در قالب پاياننامه
- پروپوزال در مورد اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- گزارش سمینار در مورد اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش
- گزارش کارورزی درباره اثر اسید فولیک غذایی بر تعداد اسپرم، آسیب DNA و جهش