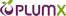جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
14,900 تومانشناسه فایل: 4351
- حجم فایل ورد: 1.5MB
- فرمت: فایل Word قابل ویرایش و پرینت (DOCx)
- تعداد صفحات فارسی: 12 انگلیسی: 6
- دانشگاه:Theoretical Molecular Biophysics Group, Institute of Physics, N. Copernicus University, Grudziadzka
- ژورنال: Chemical Physics Letters (1)
مقدمه مقاله
نیتریل هیدراتاز (Nitrile hydratase) (NHase)، یک آنزیم بیوتکنولوژیکی مهم است که با استفاده از مدلسازی کامپیوتری دینامیک مولکولی هدایت شده برای نخستین بار بررسی شده است. یک نیروی خارجی برای لیگاندهای کوتاه شده به کار رفت تا راه های انتقال را برای آکریلونیتریل (زیرلایه) و آکریلامید (محصول) مشخص نماید.نیروی کششی میانگین 120 PN در کانال آنزیم 50% از نیروی موجود در آب مدل بالاتر بود.مانع عمده ی PN 500 با βPhe37 تولید می شود. این ناحیه ممکن است مسئول فضاگزینی NHases ها باشد.
ABSTRACT Mechanical aspects of nitrile hydratase enzymatic activity. Steered molecular dynamics simulations of Pseudonocardia thermophila JCM 3095
Nitrile hydratase (NHase), an important biotechnological enzyme, has been investigated using a steered molecular dynamics computer modelling for the first time. An external force applied to the docked ligands was used to determine transport paths for acrylonitrile (substrate) and acrylamide (product). The average drag force of 120 pN within the enzyme channel is 50% higher than that in model water. The major hindrance of 500 pN is generated by βPhe37 residue. This region may be responsible for the stereoselectivity of NHases.
3. نتایج و بحث
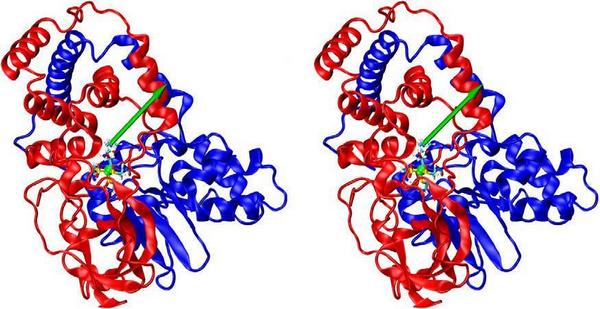
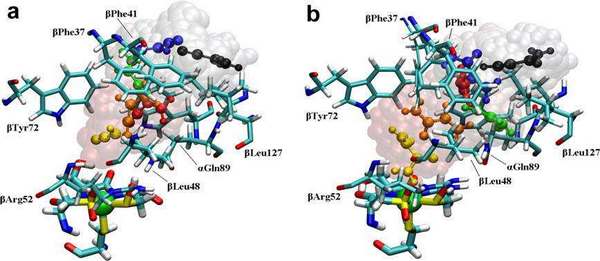
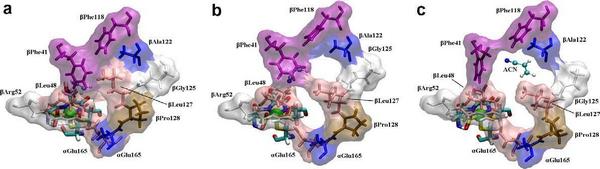
در طول یک چرخه ی کاتالیزی آنزیمی ، مولکول های زیر لایه باید به داخل NHase برسند آنگاه واکنش هیدراسیون در محل دارای اثر مجاورتی عمیقا دفن شده روی می دهد.در نهایت محصولات ترک دارای اثر مجاورتی را ترک می کند. دیتای اشعه ی ایکس آزمایشی [41] بیانگر این است که انتقال زیرلایه ها / محصولات از طریق کانال واقع در حد فاصل واحدهای فرعی α وβ روی می دهد ، همانطور که توسط هانگ و همکارانش فرض شده است [42]. لایه ی NHase در شکل 1 نشان داده شده است و پیکان سبز تقریبا جهت گیری کانال را نشان می دهد. در شکل 2 بقایای اصلی شکل دهنده ی کانال ، به طور نموداری ارائه شده است. فاصله از سطح NHase تا مرکز +co3 در حدود 15A است. در حالیکه مسیرهای انتقال لیگاند یا محصول دیگر نمی تواند مشخصا غیر محتمل شمرده شود (یا جلوگیری شود) [43] ، هر دو آنالیز اشعه ی ایکس [44،33] و شبیه سازی های MD نمونه برداری ارتقا یافته ی محلی اخیر ما در مورد [Fe-NHase [29 مربوطه بیانگر این است که این کانال نقش مهمی را در کارکرد NHase ایفا می نماید.
لازم به ذکر است جزئیات معماری داخل کانال ممکن است مسئول تنظیم دقیق NHase های خاص برای ترکیب فضا ویژه ی شبه محصولات دارویی باشد.
به منظور مشخص نمودن اینکه آمینو اسیدها انتقال زیر لایه یا لیگاند را در NHase به تاخیر می اندازند و اینکه کدام نواحی ممکن است لیگاندهای NHase را با توجه به اندازه و شکل هندسی شان تشخیص دهند، نیروی خارجی برای ACN به کار می رود ( یا یک محصول ACN).لیگاندها اول در حفره ی مکان فعال با استفاده از نرم افزار AutoDock کوتاه شد [37].مسیر نیروی اعمال شده در شکل 1 نشان داده شده است.این برداری تقریبا در طول محور کانال جهت گیری می شود، متناظر با ورودی کانال شماره ی 3 همانطور که در مرجع 43 بحث شده است، این به نظر می رسد که طبیعی ترین راه برای انتقال لیگاندها باشد.
- مقاله درمورد جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- پروژه دانشجویی جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- پایان نامه در مورد جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- تحقیق درباره جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- مقاله دانشجویی جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095 در قالب پاياننامه
- پروپوزال در مورد جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- گزارش سمینار در مورد جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095
- گزارش کارورزی درباره جنبه های مکانیکی فعالیت آنزیمی نیترول هیدراتاز و شبیه سازی های دینامیکی مولکولی هدایت شده Pseudonocardia thermophila JCM 3095