تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات

 Springer Nature
وولوم 20
ایژو 9
صفحات 880-892
سال انتشار 2013شاپا الکترونیک: 1476-5462
Springer Nature
وولوم 20
ایژو 9
صفحات 880-892
سال انتشار 2013شاپا الکترونیک: 1476-5462شاپا پرینت: 0969-7128 52 رفرنس دارد وبسایت مرجع
28,500 تومانشناسه فایل: 9468
- حجم فایل ورد: 733.7KB حجم پیدیاف: 715.2KB
- فرمت: فایل Word قابل ویرایش و پرینت (DOCx)
- تعداد صفحات فارسی: 28 انگلیسی: 13
- دانشگاه:
- Department of Pharmaceutics and Pharmaceutical Chemistry, University of Utah, Salt Lake City, UT, USA
- Graduate Program for Nanomedical Science, Yonsei University, Seoul, Republic of Korea
- Department of Bioengineering, College of Engineering, Hanyang University, Seoul, Republic of Korea
- Department of Chemical and Biomolecular Engineering, Yonsei University, Seoul, Korea
- ژورنال: Gene Therapy (1)
مقدمه مقاله
اثربخشی حامل های آدنوویروس (AD) در درمان ژنی سرطان به شدت مورد بررسی قرار گرفته است. ویژگی های چندی آدنوویروس را نامزد جذابی برای ژن درمانی می سازد از جمله: کارآیی بالای انتقال ژن هم در سلول های تقسیمی و هم غیر تقسیمی، تولید آسان ذخایر آدنوویروس با تیتر بالا، خطر کم جهش زایی الحاقی و القای تخریب نئو پلاسم توسط تکثیر ویروسی.
در میان 1600 آزمایش بالینی که درباره ژن درمانی از سال 1990 مطالعه شده، محققان آدنوویروس را به دلیل این ویژگی ها به عنوان یک حامل تحویل در بیش از 390 آزمایش بالینی انتخاب نمودند
http:// www .wiley. co. uk/ genmed /clinical.
پیشرفت قابل توجه نسل دوم آدنوویروس آنکولیتیک، قابلیت تکثیر انتخابی در سلول های سرطانی است. (2، 3، 4، 5، 6، 7، 8، 9، 10). بعد از زوال سلول های سرطانی آلوده، نتاج آدنوویروس آنکولیتیک به صورت موضعی انتشار یافته و سلول های سرطانی مجاور را آلوده می سازند. این تکرار پی در پی و زوال سلول های سرطانی باعث می شود آدنوویروس آنکولیتیک یک نماینده امیدوار کننده برای درمان ژنی سرطان با غلبه بر اثربخشی نسبتاً اندک ژن درمانی سرطان با واسطه ویروس غیر تکثیری می شود. (11، 12، 13، 14، 15، 16، 17). تکثیر خاص سلول سرطانی آدنوویروس آنکولیتیک نیز سمیت را کاهش و ایمنی را با عدم تکثیر سلول های سالم طبیعی افزایش می دهد (19، 20).
علاوه بر این ترکیب ژن درمانی و توانایی لایتیک آدنوویروس آنکولیتیک تأثیر احتمالی آدنوویروس دخیل در ژن درمانی سرطان را بیشتر افزایش می دهد. از ترکیب درمان با ویروس و ترکیب ژن های دارای نقش ضد سرطانی، مانند دکورین، ریلاکسین، سیتوکین ها و فاکتور رشد اندوتلیال عروقی یا سرRNA کوتاه مخصوص اینترلوکین 8، تا حد زیادی اثربخشی ژن درمانی سرطان را افزایش داده است (11، 13، 14 ، 21، 22، 23، 24، 25، 26، 27).
با وجود این ویژگی های درمانی سودمند، استفاده از آدنوویروس های آنکولیتیک تاکنون به دلیل القای پاسخ های ایمنی در برابر آدنوویروس و دوره کوتاه ترکیب ژن درمانی اثربخشی کمی در شرایط بالینی داشت (28).
استفاده از آدنوویروس آنکولیتیک ONYX-015 به صورت درون توموری در بیماران مبتلا به سرطان سر و گردن با تکثیر موضعی محدود ویروسی در نتیجه پاسخ ایمنی ذاتاً قوی تجویز شده است (29، 30). اثربخشی محدود این آدنوویروس آنکولیتیک در نتیجه فراگرفتن ویروس ها توسط سلول های Kupffer و هپاتوسیت هاست (31).
درمان موثر تومورهای بزرگ مستلزم حفظ دوز درمانی این ویروس در محل بیماری هدف است. برای افزایش اثربخشی ویروس درمانی آدنوویروس آزمایشاتی انجام شده که شامل تیتر آدنوویروس بالا و تزریق مکرر است اما اثربخشی توسط رهاسازی سریع این ویروس از بافت تومور به مویرگ های خونی و بافت های سالم است (32، 33،34).
اثربخشی با این واقعیت که آدنوویروس آهسته از طریق ماتریکس خارج سلولی یک تومور بسیار بزرگ پراکنده می گردد بیشتر کاهش می یابد. آلودگی ویروسی محدود سلول های مجاور دور از محل تزریق اولیه تا حد زیادی توانایی ویروس دخیل در ژن درمانی سرطان را برای موفقیت ژن درمانی سرطان محدود می سازد.
در مرحلهI آزماش بالینی با استفاده از ترکیب آدنوویروس p53 برای درمان گلیومای (glioma) عود کننده، ناحیه سلول عبور شده فراتر از 5 میلی متر از محل تزریق گسترش نمی یابد (35).
علاوه بر این، بافت برداری تومور از افراد در مرحلهII آزمایش بالینی مطالعه سرطان سر و گردن نشان داد که آدنوویروس آنکولیتیک ONYX-015 در بافت های تومور وجود دارد اما الگوی انتشار ویروسی در اصل بسیار موضعی بود که موید آن است که این ویروس در سراسر بافت تومور توزیع نشده است (30).
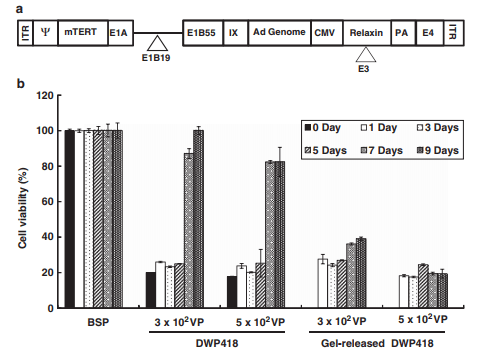
با هدف بهبود گسترش ویروسی آنکولیتیک و نفوذ تومور برای پیشبرد ژن درمانی سرطان به تازگی اهمیت و کاربرد هورمون پپتید ریلاکسین را نشان دادیم. ریلاکسین به عنوان یک بازدارنده قوی ترکیب کلاژن زمانی است که کلاژن بروز می یابد اما سطوح پایه ترکیب کلاژن در مقایسه با سایر سیتوکین های تلفیقی کلاژن، مانند اینترفرون γ36 و فاکتور تغییر شکل رشد β تغییر قابل ملاحظه ای نمی یابد (37).
DWP418 یک آدنوویروس آنکولیتیک است که ریلاکسین را توصیف نموده و نشان می دهد که توزیع ویروسی در تومورهای بزرگ به طور قابل توجهی بهبود یافته که منجر به کارآیی عبور بالاتر و افزایش اثربخشی ضد تومور می شود (2، 22).
توسعه بهینه سازی آدنوویروس و سیستم تحویل موثر آدنوویروس درمان حامل آدنوویروس را با افزایش ایمنی، اثربخشی و دوره توصیف ترانس ژن بیشت بهبود می بخشد.
به تازگی، یک سیستم تحویل ویروس قابل تزریق موضعی برای استفاده می شود پروتئین مورفوژنیک استخوان -2- بیانگر ژن درمانی آدنوویروس استئوژنز با استفاده از یک حامل کلاژن (38)، کمپلکس آنتی بادی با آدنوویروس در حامل کلاژن (39)، لنتی ویروس در اسید هیالولونیک / ماتریکس کلاژن (40) و مخلوط پلیمرهای پروتئینی الاستین ابریشم مانند / آدنوویروس برای الگوهای ژنوگرافت تومور سرطان سینه و سر و گردن به دام می افتد (34). با استفاده از سیستم عبور آدنوویروس مبتنی بر زمینه به عبور گسترده و یکنواخت ویروس کمک می گردد (34، 41).
علاوه بر این، تزریق موضعی یک سیستم تحویل آدنوویروس مبتنی بر ماتریس مانع انتشار سریع ویروس و تزریق از تومور به بافت طبیعی حین تزریق داخل تومور می شود که منجر به عبور کم سلول های طبیعی می گردد (42، 43). با این حال، هیچ مطالعه قبلی از تحویل آدنوویروس آنکولیتیک موضعی و پایدار استفاده نکرده است که به وضوح نشان دهنده اثرات درمانی این آدنوویروس در داخل بدن باشد.
علاوه بر این، این مساله هنوز ناشناخته است که آیا تحویل فضایی آدنوویروس با استفاده از یک تحویل پایدار مبتنی بر ماتریس فعالیت زیستی آدنوویروس را برای تسهیل طولانی مدت تکثیر آدنوویروس آنکولیتیک و کشتن سلول های سرطانی به صورت کافی حفظ می کند.
در این مطالعه، ما آدنوویروس قابل تزریق موضعی را در یک سیستم محزن مبتنی بر ماتریس حاوی یک ژل آلژینات تخریب پذیر زیستی آزمایش نمودیم که یک پلیمر طبیعی است که غالباً برای کاربردهای پزشکی استفاده می شود (44). آلژینات قبلاً به عنوان حامل ژل تزریقی برای پروتئین (45، 46) و سلول ها (47) به دلیل سازگاری زیستی آن، سمیت پایین، هزینه نسبتاً پایین و رفتار انعقادی خفیف با کاتیونهای دو ظرفیتی استفاده می شد.
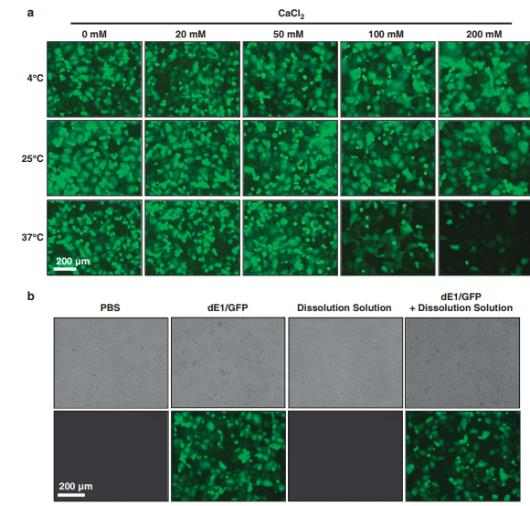
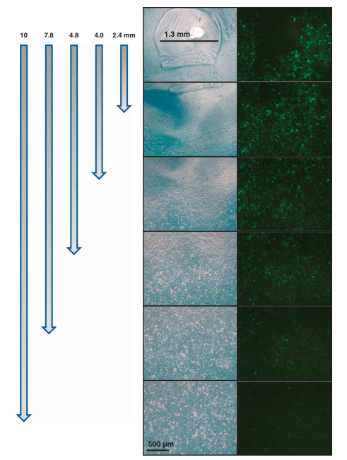
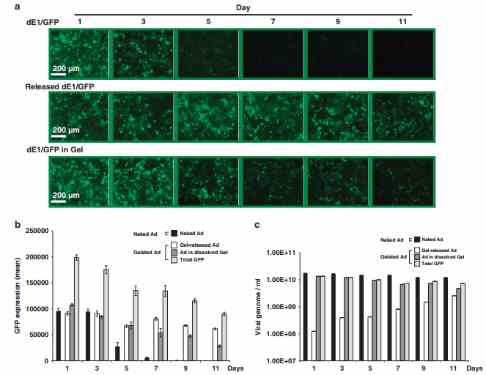
در اینجا ما خصوصیات آزمایشگاهی آدنوویروس محبوس در ژل آلژینات، ترکیب ژن طولانی در نتیجه انتشار آدنوویروس پایدار و محیط محافظ درون ژل و آدنوویروس آنکولیتیک پیشرفته دخیل در کشتن سلول های سرطانی را گزارش نمودیم.
ما همچنین نشان دادیم که تزریق موضعی آدنوویروس آنکولیتیک محصور در ژل منجر به انتشار پایدار آدنوویروس با فعالیت طولانی در داخل بدن و افزایش اثرات درمانی ضد تومور می گردد. تکثیر موضعی ممتاز و پیشرفته آدنوویروس آنکولیتیک به انتشار پایدار در ژل محافظ مرتبط است که با آنالیز ایمونوهیستوشیمی و کمی(Q-PCR) PCR تعیین می گردد.
ABSTRACT Local sustained delivery of oncolytic adenovirus with injectable alginate gel for cancer virotherapy
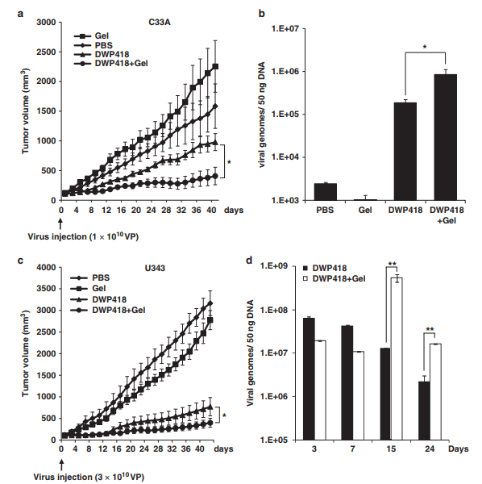
Adenoviruses (Ad) have been investigated for their efficacy in reducing primary tumors after local intratumoral administration. Despite high Ad concentrations and repetitive administration, the therapeutic efficacy of Ad has been limited because of rapid dissemination of the Ad into the surrounding normal tissues and short maintenance of Ad biological activity in vivo. To maximize the therapeutic potential of Ad-mediated gene therapeutics, we investigated the efficacy of local, sustained Ad delivery, using an injectable alginate gel matrix system. The biological activity of Ad loaded in alginate gel was prolonged compared with naked Ad, as evidenced by the high green fluorescent protein gene transduction efficiency over an extended time period. Moreover, oncolytic Ad encapsulated in alginate gel elicited 1.9- to 2.4-fold greater antitumor activity than naked Ad in both C33A and U343 human tumor xenograft models. Histological and quantitative PCR analysis confirmed that the oncolytic Ad/alginate gel matrix system significantly increased preferential replication and dissemination of oncolytic Ad in a larger area of tumor tissue in vivo. Taken together, these results show that local sustained delivery of oncolytic Ad in alginate gel augments therapeutic effect through selective infection of tumor cells, sustained release and prolonged maintenance of Ad activity.
Introduction
The efficacy of adenovirus (Ad) vectors in cancer gene therapy has been heavily investigated. Several characteristics make Ad attractive gene therapy candidates, including high gene-transfer efficiency in both dividing and non-dividing cells, easy production of high-titer Ad stocks, low risk of insertional mutagenesis and induction of oncolysis by viral replication. Among the 1600 clinical trials studying gene therapy since 1990, investigators have chosen Ad as a delivery vector in over 390 clinical trials because of these characteristics http:// www . wiley . co . uk / genmed / clinical /. A significant advance in the second generation of oncolytic Ad is the capability of replicating selectively in cancer cells.2, 3, 4, 5, 6, 7, 8, 9, 10 After the lysis of the infected cancer cells, progenies of oncolytic Ad disseminate locally and infect neighboring cancer cells. This sequential replication and lysis of cancer cells makes oncolytic Ad a promising candidate for cancer gene therapy, overcoming the modest efficacy of non-replicating virus-mediated cancer gene therapy.11, 12, 13, 14, 15, 16, 17 Cancer cell-specific replication of oncolytic Ad also reduces toxicity and maximizes safety by not replicating in normal healthy cells18, 19, 20 Moreover, the combination of therapeutic gene expression and lytic ability of oncolytic Ad further increase the likely impact of Ad-mediated cancer gene therapy. Combining virotherapy and expression of genes with anti-cancer roles, such as decorin, relaxin, cytokines and vascular endothelial growth factor- or interleukin-8-specific short hairpin RNA, have greatly increased the efficacy of cancer gene therapy.11, 13, 14, 21, 22, 23, 24, 25, 26, 27
Despite these therapeutically advantageous characteristics, the use of oncolytic Ads has thus far had low efficacy in clinical settings because of induction of immune responses against Ad and the short duration of therapeutic gene expression.28 ONYX-015 oncolytic Ad administered intratumorally into patients with head and neck cancer demonstrated limited local viral replication as a result of robust innate immune responses.29, 30 The limited efficacy of this oncolytic Ad is a result of viruses being engulfed by Kupffer cells and hepatocytes.31 Effective treatment of large tumors requires maintenance of the therapeutic dose of the virus at targeted disease site. To increase the effectiveness of Ad virotherapy, experiments have been conducted involving high Ad titer and repeated injections, but efficacy was hampered by fast clearance of the virus from tumor tissue to the blood microvasculature and normal tissues.32, 33, 34
Efficacy is further diminished by the fact that Ad is slow to diffuse through the extracellular matrix of a very large tumor. The limited viral infection of neighboring cells far from the initial injection site greatly limits the ability of virus-mediated cancer gene therapy to be a successful form of cancer gene therapy. In a phase I clinical trial using p53-expressing Ad to treat recurrent glioma, the zone of transduced cells did not extend beyond 5 mm from the injection site.35 Moreover, tumor biopsies taken from subjects in a phase II clinical trial studying head and neck cancer demonstrated that ONYX-015 oncolytic Ad are present in tumor tissues, but the pattern of viral dissemination was very focal in nature, indicating that the virus did not distribute evenly throughout the tumor tissue.30 With the aim of improving oncolytic viral spread and tumor penetration to enhance cancer gene therapy, we recently demonstrated the importance and utility of the peptide hormone relaxin. Relaxin has been shown to be a potent inhibitor of collagen expression when collagen is overexpressed, but does not markedly alter basal levels of collagen expression, in contrast to other collagen-modulatory cytokines, such as interferon-γ36 and transforming growth factor-β.37 DWP418 is an oncolytic Ad that expresses relaxin and demonstrates markedly improved viral distribution in large tumors, resulting in higher transduction efficiency and enhanced antitumor efficacy.2, 22
The development of optimized Ad and an effective Ad delivery system would further advance Ad vector therapy by maximizing safety, efficacy and duration of transgene expression. Recently, a locally injectable virus delivery system has been used for bone morphogenic protein-2-expressing Ad gene therapy of osteogenesis using a collagen carrier,38 antibody complexation with Ad in a collagen carrier,39 lentivirus entrapment in hyalulonic acid/collagen matrix40 and mixture of silk elastin-like protein polymers/Ad for breast and head and neck cancer xenograft tumor models.34 The use of a matrix-based Ad transduction system assisted widespread and uniform virus transduction.34, 41 In addition, the local injection of a matrix-based Ad delivery system prevented rapid viral dissemination and infusion from tumor to normal organ during intratumoral injection, which results in low normal cell transduction efficiency.42, 43 However, no previous studies have used localized and sustained oncolytic Ad delivery to clearly demonstrate the therapeutic effects of this Ad in vivo. Moreover, it is as yet unknown whether spatial Ad delivery using a matrix-based sustained delivery retains sufficient Ad biological activity to facilitate long-lasting oncolytic Ad replication and cancer cell killing.
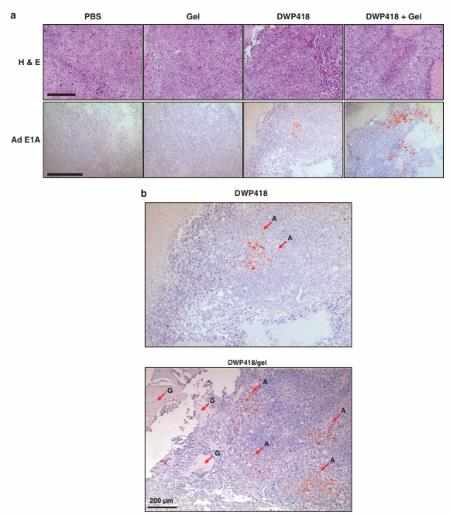
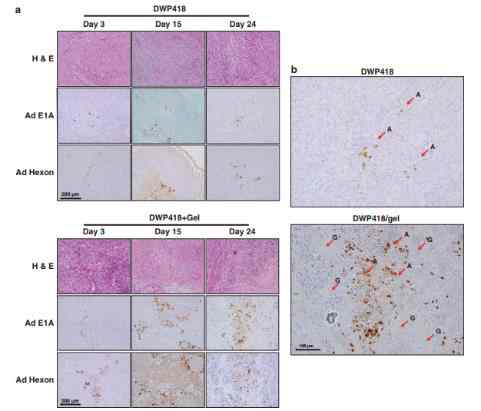
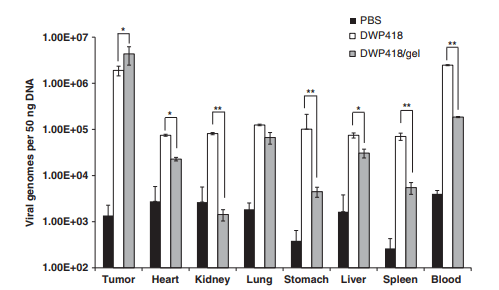
In this study, we tested a locally injectable Ad in a matrix-based depot system involving a biodegradable alginate gel, a natural polymer that is frequently used in biomedical applications.44 Alginate has been previously used as an injectable gel carrier for protein45, 46 and cells47 because of its biocompatibility, low toxicity, relatively low cost and mild gelation behavior with divalent cations. Here we report the in vitro characterization of Ad entrapped in alginate gel, prolonged gene expression as a result of the sustained Ad release and protective microenvironment within the gel, and enhanced oncolytic Ad-mediated cancer cell killing. We also demonstrate that local injection of oncolytic Ad-loaded gel resulted in sustained release of Ad with prolonged activity in vivo, leading to enhanced antitumor therapeutic effects. Enhanced local preferential replication of oncolytic Ad mediated by sustained release in the protective gel was determined by immunohistochemical analysis and quantitative PCR (Q–PCR).
- مقاله درمورد تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- پروژه دانشجویی تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- تحویل آدرن ویروسی آنکولیتیک برای درمان سرطان با ویروس
- پایان نامه در مورد تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- تحقیق درباره تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- مقاله دانشجویی تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات در قالب پاياننامه
- پروپوزال در مورد تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- گزارش سمینار در مورد تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات
- گزارش کارورزی درباره تحویل موضعی پایدار آدنوویروس آنکولیتیک آنکولیتیک جهت درمان سرطان با ویروس با ژل تزریقی آلژینات