هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین

شاپا پرینت: 0022-0795 وبسایت مرجع رفرنس دارد
14,900 تومانشناسه فایل: 8021
- حجم فایل ورد: 244.8KB حجم پیدیاف: 178.7KB
- فرمت: فایل Word قابل ویرایش و پرینت (DOCx)
- تعداد صفحات فارسی: 14 انگلیسی: 8
- دانشگاه:
- School of Medicine, The University of Queensland, Herston, 4006 Brisbane, Queensland, Australia
- Conjoint Endocrine Laboratory, Queensland Institute of Medical Research, Bancroft Centre, Royal Brisbane and Women’s Hospital, 300 Herston Road, Herston, 4029 Brisbane, Queensland, Australia
- Disciplines of Medicine, Obstetrics and Gynaecology, The University of Queensland, Herston, 4006 Brisbane, Queensland, Australia
- ژورنال: Journal of Endocrinology (2)
چکیده
تکامل عملکرد غده تیروئید جنین به جنین زایی، تمایز و بلوغ غده تیروئید وابسته است. این عمل همراه با رشد و تکامل محور هیپوتالاموس-هیپوفیز-تیروئید و متابولیسم هورمون تیروئید است که منجر به تولید، ترشح و فعالیت هورمون تیروئید میشود. در طول دوران بارداری، ذخیره ثابتی از تیروکسین مادری (T4) وجود دارد که در گردش خون جنینی تا حدود 4 هفته بعد از لانه گزینی جنین دیده می شود. این ذخیره برای عصب زایی اولیه و طبیعی جنین ضروری است. غلظتهای تریدوتیرونین در طول بارداری به دلیل سوخت و ساز بدن توسط دیدیناز نوع 3 جفتی و جنینی بسیار کم است. غلظت های T4 برای حفظ غلظت های پایین به شدت تنظیم شدهاند و برای حفاظت از جنین و رسیدن به نقاط عصبی مهم مانند قشر مغز در مراحل خاص رشد و نمو بسیار ضروری هستند. محرک های غشایی فراوانی برای هورمون های تیروئیدی شناخته شده در مغز جنین وجود دارند که نقش بسیار مهمی را در تنظیم غلظت های تیروئیدی در ساختارهای مهم ایفا می کنند. آن ها همچنین مسیر تعامل هورمون تیروئیدی درون سلولی با گیرنده های خود را که موجب فعال شدن آن ها می شوند؛ فراهم می کنند. یک رویکرد رو به رشد از شواهد تجربی در موش ها و انسان ها وجود دارد و نشان می دهند که حتی هیپوتیروکسینمی مادری خفیف هم ممکن است منجر به ناهنجاری هایی در تکامل سیستم عصبی جنین شود. بررسی ما بر روی آنتوژنی هورمون تیروئیدی در طول تکامل جنین و بر انتقال دهنده غشایی و عمل TR در مغز، تمرکز خواهد کرد.
مقدمه مقاله
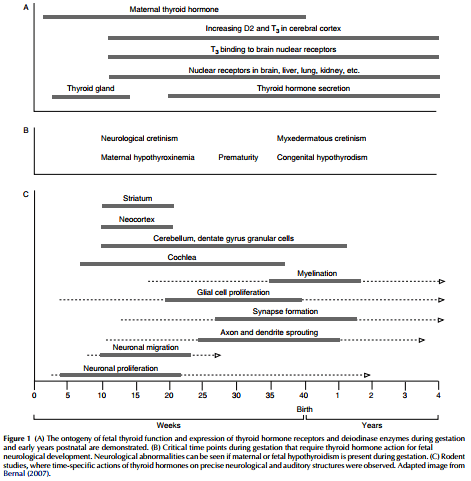
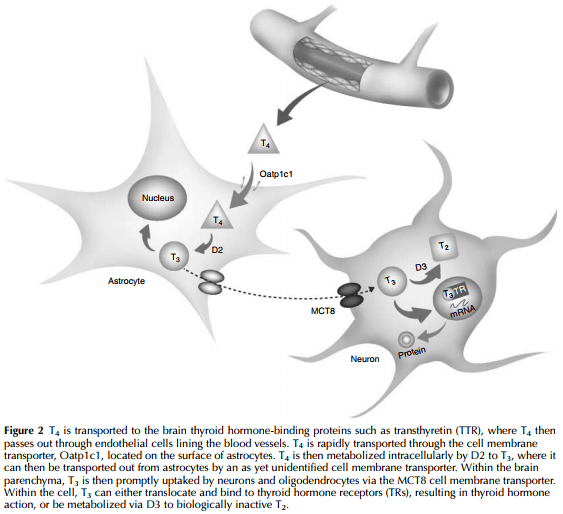
در حالی که از صدها سال پیش اختلال رشد ذهنی و جسمی ساکنان کوه های آلپ با کمبود ید به عنوان کرتینیسم شناخته شده بود؛ ارتباط بین کمبود ید، کم کاری تیروئید و تکامل ناقص سیستم عصبی بسیار دیرتر تشخیص داده شد (Cranefield 1962, Morreale de Escobar et al 2004). هورمون های تیروئیدی (تیروکسین (T4) و تری یدوتیرونین (T3)) برای پیشرفت و حفظ فرایندهای فیزیولوژیکی طبیعی به خصوص فرآیندهای سیستم عصبی مرکزی که در آنها هورمون های تیروئیدی در طول دوران بارداری به رشد و تکامل مغز کمک میکنند؛ ضروری هستند (Joffe & Sokolov 1994, Neale et al. 2007). هورمون های تیروئیدی در درجه اول ژن های درگیر در میلین سازی و تمایز سلول عصبی/ گلیال را تنظیم می کنند (Bernal 2005). انتقال هورمون های تیروئیدی به مغز جنین یک فرآیند پیچیده است که در زمان های مختلف به بیان گیرنده های هورمون های تیروئیدی در مغز (TRs)، هورمون تیروئیدی مادر- جنین و ناقل یدید، یک سیستم پیچیده از فیدبک اندوکرین (محور هیپوتالاموس- هیپوفیز- تیروئید (HPT) و متابولیسم هورمون تیروئید توسط کبد و آنزیم های دئودیناز مغز (دئودیناز نوع 2 (D2) و دئودیناز نوع 3 (D3)) نیاز دارد تا از سطح ثابت هورمون ها اطمینان حاصل شود (Zoeller et al. 2007).
غده تیروئید جنین در هفته 11 تا 12، نزدیک به پایان سه ماهه اول کامل می شود و حدودا در هفته شانزدهم، هورمون های تیروئیدی را ترشح میکند (Obregon et al. 2007). در طول این دوره، برای اطمینان از رشد و تکامل طبیعی سیستم عصبی بایستی ذخیره کافی از هورمون های تیروئید مادری حفظ شود. جنین های مبتلا به کم کاری تیروئید بعد از تولد از اختلالات مختلفی از جمله عقب ماندگی ذهنی، ناشنوایی و اسپاسم رنج می برند. کمبود ید شدید که موجب کم کاری مادرزادی و جنینی تیروئید می شود در سراسر جهان جزء شایع ترین علت عقب ماندگی ذهنی است (Glinoer 2001, Morreale de Escobar et al 2004, Pearce 2009). اگر جایگزینی هورمون تیروئید در نوزادان مبتلا به کم کاری مادرزادی تیروئید بلافاصله بعد از تولد شروع نشود؛ اختلال بیشتر در تکامل شناختی رخ می دهد. شواهد اخیر نشان می دهند که حتی کاهش خفیف در سطوح هورمون تیروئید مادر در اوایل دوران بارداری با کاهش بهره هوشی در فرزندان مرتبط است (LaFranchi & Austin 2007, Gyamfi et al. 2009). مکانیسم های مولکولی که توسط آن ها هورمون های تیروئیدی بر ساختارهای عصبی جنین اثر می گذارند؛ هنوز به خوبی درک نشده اند. این بررسی به طور مختصر برخی از جنبه های نقش هورمون های تیروئیدی در رشد و تکامل سیستم عصبی جنین و با تمرکز بر انتقال دهنده های TH و فعال سازی گیرنده در مغز را مرور می کند.
ABSTRACT Thyroid hormones and fetal neurological development
The development of fetal thyroid function is dependent on the embryogenesis, differentiation, and maturation of the thyroid gland. This is coupled with evolution of the hypothalamic-pituitary-thyroid axis and thyroid hormone metabolism, resulting in the regulation of thyroid hormone action, production, and secretion. Throughout gestation there is a steady supply of maternal thyroxine (T(4)) which has been observed in embryonic circulation as early as 4 weeks post-implantation. This is essential for normal early fetal neurogenesis. Triiodothyronine concentrations remain very low during gestation due to metabolism via placental and fetal deiodinase type 3. T(4) concentrations are highly regulated to maintain low concentrations, essential for protecting the fetus and reaching key neurological sites such as the cerebral cortex at specific developmental stages. There are many known cell membrane thyroid hormone transporters in fetal brain that play an essential role in regulating thyroid hormone concentrations in key structures. They also provide the route for intracellular thyroid hormone interaction with associated thyroid hormone receptors, which activate their action. There is a growing body of experimental evidence from rats and humans to suggest that even mild maternal hypothyroxinemia may lead to abnormalities in fetal neurological development. Our review will focus on the ontogeny of thyroid hormone in fetal development, with a focus on cell membrane transporters and TR action in the brain.
Introduction
While the impaired mental and physical development of inhabitants of the iodine-deficient Alps was recognized as cretinism hundreds of years ago, the link between iodine deficiency, hypothyroidism, and impaired neurologic development was made very much later (Cranefield 1962, Morreale de Escobar et al. 2004). Thyroid hormones (thyroxine (T4) and triiodothyronine (T3)) are essential for the development and maintenance of normal physiological processes, especially those of the central nervous system, where thyroid hormones assist in brain maturation throughout gestation (Joffe & Sokolov 1994, Neale et al. 2007). Thyroid hormones primarily regulate genes involved in myelination and neuronal\glial cell differentiation (Bernal 2005). Delivery of thyroid hormones to the fetal brain is a complex process requiring, at different times, expression of brain thyroid hormone receptors (TRs), materno-fetal thyroid hormone and iodide transport, an intricate system of endocrine feedback (the hypothalamic–pituitary–thyroid (HPT) axis and thyroid hormone metabolism by liver and brain deiodinase enzymes (deiodinase type 2 (D2) and deiodinase type 3 (D3)) to ensure basal levels are sustained (Zoeller et al. 2007)).
The fetal thyroid gland reaches maturity by week 11–12, close to the end of the first trimester and begins to secrete thyroid hormones by about week 16 (Obregon et al. 2007). During this period, an adequate supply of maternal thyroid hormones must be sustained to ensure normal neurological development. Hypothyroid fetuses suffer various postnatal disorders including mental retardation, deafness, and spasticity. Severe iodine deficiency, which causes both maternal and fetal hypothyroidism, is, worldwide, the most common cause of mental retardation (Glinoer 2001, Morreale de Escobar et al. 2004, Pearce 2009). If thyroid hormone replacement for congenital hypothyroid babies is not initiated soon after birth, further impairment of cognitive development occurs. More recent evidence suggests that even mild reductions in maternal thyroid hormone levels in early pregnancy are associated with reduced IQ in offspring (LaFranchi & Austin 2007, Gyamfi et al. 2009). The molecular mechanisms by which thyroid hormones affect fetal neurological structures are still not well understood. This review will briefly discuss some current aspects of the role of thyroid hormones in fetal neurological development, focusing on TH transporters and receptor activation in the brain.
- مقاله درمورد هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- هورمون های تیروئید و توسعه عصبی جنین
- پروژه دانشجویی هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- بررسی هورمون های تیروئیدی و رشد عصبی جنین
- پایان نامه در مورد هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- تحقیق درباره هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- مقاله دانشجویی هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین در قالب پاياننامه
- پروپوزال در مورد هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- گزارش سمینار در مورد هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین
- گزارش کارورزی درباره هورمون های تیروئید و تکامل نورولوژیکی و عصبی جنین