مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن

19,500 تومانشناسه فایل: 7445
- حجم فایل ورد: 152.3KB حجم پیدیاف: 336.6KB
- فرمت: فایل Word قابل ویرایش و پرینت (DOCx)
- تعداد صفحات فارسی: 21 انگلیسی: 9
- دانشگاه:Division of Infection & Immunity, The Roslin Institute and Royal (Dick) School of Veterinary Studies, University of Edinburgh, Easter Bush Campus, Midlothian EH25 9RG, UK
- ژورنال: Veterinary Immunology and Immunopathology (1)
چکیده
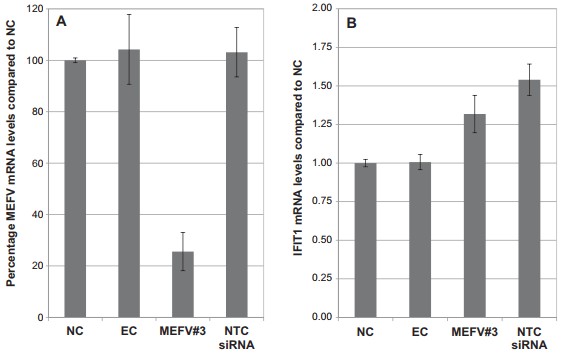
دستکاری مسیر تداخل RNA با استفاده از آر ان ای خاموشگر (siRNA) اغلب به عنوان روش خاموشی ژن مورد استفاده قرار گرفته است. با این حال، تحویل siRNA به سلول های اولیه، به ویژه ماکروفاژهای اولیه، اغلب به عنوان چالش در نظر گرفته می شود. در اینجا بررسی مناسب بودن دو روش انتقال موقت و الکتروپوریشن، برای تحویل siRNA مورد نظر علیه ژن معروف تنظیم ایمنی تب مدیترانه ای (MEFV) به ماکروفاژهای مشتق شده از مونوسیت های گاوی (bMDM) گزارش است. یازده معرف ترانسفکشن (ترا آلایی) تجاری با نتایج متفاوت در ارتباط با جذب siRNA، از کار انداختن ژن مورد نظر، سمیت سلولی و القای پاسخ اینترفرون نوع I (IFN ) مورد بررسی قرار گرفتند. سه معرف ترانسفکشن: لیپوفکتامین 2000، لیپوفکتامین RNAiMAX و Dharma FECT 3 بهترین نتایج را به دست می آورند. با این حال، تمام معرف های ترانسفکشن بررسی شده، یک پاسخ IFN را در غیاب siRNA القا می کردند که می تواند با کاهش دوره انکوباسیون معرف ترانسفکشن به حداقل برسد. علاوه بر این، تحویل بهینه سازی شده ی siRNA به bMDM از طریق الکتروپوراسیون، سطوح قابل مقایسه ای از از کار انداختن ژن را به عنوان ترانسفکشن موقت، بدون یک پاسخ قابل تشخیص IFN، و سطوح بالاتر سمیت سلولی را به دست می آورد. روش های ترانسفکشن و الکتروپوریشن گذاری بهینه شده ممکن است نقطه شروع برای بهینه سازی تحویل siRNA به ماکروفاژهای مشتق شده از سایر گونه ها یا سلول های دیگر شود که بررسی siRNA در آن ها دشوار است.
مقدمه مقاله
کشف مسیر تداخل RNA (RNAi) که در آن RNA دو رشته ای (dsRNA) باعث خاموشی بیان ژن پس از رونویسی شده (Fire et al., 1998) و پس از آن بیان اینکه این مسیر می تواند با توالی های RNA اگزوژن کوتاه مورد استفاده قرار گیرد (Elbashir et al., 2001)، بسیاری از زمینه های مطالعات سلولی را متحول کرده است. مسیر RNAi از نظر تکاملی حفاظت شده است و در گیاهان، قارچ ها و سلول های حیوانی وجود دارد و چندین عملکرد از جمله حفظ سلول ها از dsRNA ویروسی و ترانسپوزون ها، و همچنین تنظیم بیان ژن از طریق تخریب mRNA، اصلاح کروماتین و سرکوب ترجمه دارد (reviewed by Dykxhoorn and Lieberman, 2005). در سیتوپلاسم سلول، میکرو RNA درونزاد (miRNA[1]) یا dsRNA اگزوژن توسط پروتئین Dicer به RNA مداخله گر کوتاه با 21-23 نوکلئوتید (siRNA[2]) پردازش شده و با کمپلکس خاموشی ناشی از RNA چند واحدی (RISC[3]) ترکیب می شود. رشتههای RNA از هم جدا شده و رشته آنتیسنس (راهنما) به mRNA با توالی مکمل متصل شده که بسته به اندازه مکمل توالی، منجر به شکست mRNA یا سرکوب ترجمه می شود (reviewed by Shan, 2010).
توانایی مهار مسیر RNAi، از طریق جذب siRNA سنتزی به سلول یا از طریق وارد کردن حامل های بیان کنندهی RNA سر سنجاقی (shRNA) که از پیش سازهای miRNA تقلید می کند، باعث خاموش شدن تقریبا هر ژن از هر موجود شده و اثبات شده است که به عنوان یک ابزار دقیق برای تحقیقات ژنتیکی معکوس در مورد عملکرد ژن است. کتابخانه های siRNA در حال حاضر برای انسان و موش وجود دارد که باعث غربالگری با توان بالا هزاران ژن به طور همزمان می شود، که باعث افزایش دانش ما و شناسایی ژن های جدید درگیر در مسیرهای سلولی و تعاملات میزبان-پاتوژن می شود (Zhou et al., 2008; Jayaswal et al., 2010). از آنجا که تقریبا هر ژنی می تواند خاموش شود، در صورت انتقال siRNAs به سلول ها و اندام های مورد نظر، این فناوری پتانسیل درمانی بسیار بالا داشته و در حال حاضر، چندین روش درمانی با siRNA در آزمایش های فاز II و III قرار دارند (reviewed by Whitehead et al., 2009). یک مزیت عمده استفاده از مسیر RNAi، خاموش کردن ژن ها در گونه های غیر مدل است، که در آن ها معرف محدود بوده اما اطلاعات توالی ها در دسترس است. این امر در حیوانات مزرعه ای درست است که در آن ها توالی یابی ژنوم منجر به ایجاد منابع بزرگ توالی شده ولی تعداد معرف هایی مانند آنتی بادی ها و جانوران تراریخته در دسترس محدود است. خاموشی ژن توسط siRNA در حال حاضر به طور معمول در مطالعات انجام شده در گاو (Ma and Corl, 2012)، گوسفند (Smith et al., 2012)، مرغ (Qi et al., 2013)، خوک (Shi et al., 2013) و ماهی قزل آلا (Kumari et al., 2013) با استفاده از لاینهای سلولی و برخی از سلولهای اولیه مورد استفاده قرار می گیرد. با این حال، مشکلاتی در زمینه معرفی نوکلئوتید های برون زاد، از جمله siRNA، به سلول های اولیه خاص، به ویژه ماکروفاژهای اولیه وجود دارد (بررسی شده توسط Zhang et al., 2009) و مطالعات انجام شده با استفاده از siRNA برای بررسی ژن های ماکروفاژها نسبت به مطالعه سایر انواع سلول ها به تاخیر افتاده است. چندین دلیل برای این مشکلات وجود دارد که به عملکرد ماکروفاژها مرتبط است. ماکروفاژها چند نقش مهم را در سیستم ایمنی بدن ایفا می کنند. آن ها پاتوژن ها و سیگنال های خطر را تشخیص داده و از طریق فاگوسیتوز و نابودی عوامل بیماری زا، ارائه آنتی ژن و ترشح واسطه های ایمنی به آن ها پاسخ می دهند. به همین دلیل، آنزیم های زیادی را بیان کرده که میتوانند باعث تخریب نوکلئوتیدها شده و به سرعت و به شدت به حضور ذرات خارجی واکنش نشان می دهند. پژوهش ما بر بررسی نقش ماکروفاژهای گاوی در طول آلودگی با عوامل بیماریزای مختلف مانند Theileria annulata تمرکز دارد (Jensen et al., 2009). به عنوان بخشی از یک پروژه در حال اجرا، ما خواستار بررسی اهمیت کارکردی ژنهای بیان کننده ماکروفاژ از طریق خاموش کردن هدفمند ژن ها در ماکروفاژ های مشتق شده از مونوسیت های اولیه گاوی (bMDM) هستیم. بر اساس دانش ما، استفاده از siRNA یا shRNA برای از بین رفتن بیان ژن در ماکروفاژهای اولیه گاوی، پیش از این گزارش نشده است. بنابراین روشهایی برای خاموش کردن ژنهای ماکروفاژ گاوی با استفاده از مسیر RNAi مورد بررسی قرار گرفت. ناقلین ویروسی مانند لنتی ویروس ها (ویروس آهسته گستر)، می توانند به ژنوم سلول های غیر قابل تقسیم متصل شده و منجر به بیان ساختاری shRNA و خاموشی طولانی مدت ژن شوند (مرور شده توسط Zhang et al., 2009) و لنتی ویروس ها به طور موفق باعث ترانسداکشن shRNA به ماکروفاژهای اولیه انسانی می شوند (Lee et al., 2003). با این حال، یکی از عملکردهای ماکروفاژها، پاسخ به حضور ویروس ها است، که ممکن است بر چالش پاسخ های بعدی با پاتوژن ها تاثیر بگذارد. بنابراین، تلاش هایی برای بهینه سازی خاموشی گذرای ژن در bMDM با استفاده از siRNA کمتر ایمنی انجام شد.
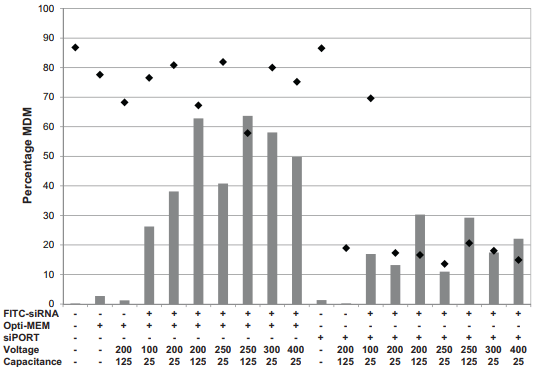
دو تکنیک غالب که به طور موفق برای وارد کردن siRNA به ماکروفاژهای اولیه مشتق شده از سایر گونه های غیر از گاو مورد استفاده قرار گرفته است، شامل انتقال موقت (Zhang et al., 2005; Wati et al., 2007; Behmoaras et al., 2008; Lietzen et al., 2011) و الکتروپوریشن (Wiese et al., 2010) است. انتقال موقت، شامل استفاده از لیپیدهای کاتیونی است که با RNA یا DNA های با بار منفی برهمکنش داشته و از طریق نیروهای الکترواستاتیک، لیپوپلکس ها را تشکیل می دهد (reviewed by Zuhorn et al., 2007) که از طریق اندوسیتوز جذب می شوند. الکتروپوریشن شامل استفاده از یک میدان الکتریکی خارجی است که نفوذپذیری پلاسمای سلول را به طور موقت افزایش داده و باعث تشکیل خلل و فرج در غشای پلاسمایی می شود که از طریق آن ها RNA یا DNA می توانند به طور مستقیم وارد سلول های شوند (Neumann et al., 1982). در اینجا بررسی های ما در مورد خاموش کردن ژن siRNA در bMDM گاوی گزارش و بهینه سازی تحویل siRNA از طریق انتقال موقت و الکتروپوریشن توصیف شده است.
[1] microRNA
[2] short interfering RNA
[3] RNA-induced silencing complex
ABSTRACT Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation
The manipulation of the RNA interference pathway using small interfering RNA (siRNA) has become the most frequently used gene silencing method. However, siRNA delivery into primary cells, especially primary macrophages, is often considered challenging. Here we report the investigation of the suitability of two methodologies: transient transfection and electroporation, to deliver siRNA targeted against the putative immunomodulatory gene Mediterranean fever (MEFV) into primary bovine monocyte-derived macrophages (bMDM). Eleven commercial transfection reagents were investigated with variable results with respect to siRNA uptake, target gene knock-down, cell toxicity and type I interferon (IFN) response induction. Three transfection reagents: Lipofectamine 2000, Lipofectamine RNAiMAX and DharmaFECT 3, were found to consistently give the best results. However, all the transfection reagents tested induced an IFN response in the absence of siRNA, which could be minimized by reducing the transfection reagent incubation period. In addition, optimized siRNA delivery into bMDM by electroporation achieved comparable levels of target gene knock-down as transient transfection, without a detectable IFN response, but with higher levels of cell toxicity. The optimized transient transfection and electroporation methodologies may provide a starting point for optimizing siRNA delivery into macrophages derived from other species or other cells considered difficult to investigate with siRNA.
Introduction
The discovery of the RNA interference (RNAi) pathway, where double-stranded RNA (dsRNA) post-transcriptionally silences gene expression (Fire et al., 1998) and the subsequent demonstration that this pathway could be utilized with short, exogenous RNA sequences (Elbashir et al., 2001) have revolutionized many areas of cellular research. The RNAi pathway is evolutionary conserved, being present in plants, fungi and animal cells, and has multiple functions; protecting cells from viral dsRNA and transposons, as well as regulating gene expression by the degradation of mRNA, translational repression and chromatin modifications (reviewed by Dykxhoorn and Lieberman, 2005). In the cell cytoplasm, endogenous microRNA (miRNA) or exogenous dsRNA are typically processed into 21–23 nucleotide short interfering RNA (siRNA) by the Dicer protein and integrated into the multi-subunit RNA-induced silencing complex (RISC). The RNA strands are separated and the antisense (guide) strand binds mRNA with complementary sequence, resulting in mRNA cleavage or translational repression, depending on the extent of sequence complementarity (reviewed by Shan, 2010).
The ability to harness the RNAi pathway, either by the uptake of synthetic siRNA into cells, or by the introduction of vectors that express short hairpin RNA (shRNA) that mimic miRNA precursors, allows the silencing of virtually any gene of any organism and has proved to be an elegant tool for the reverse genetic investigation of gene function. siRNA libraries are now available for humans and mice, which allow high throughput screening of thousands of genes simultaneously, which have expanded our knowledge and identified novel genes involved in cellular pathways and host–pathogen interactions (Zhou et al., 2008, Jayaswal et al., 2010). Since nearly any gene can be silenced the technology has great therapeutic potential, if the siRNAs can be delivered to the desired cells or organs, and several siRNA therapeutics are currently in phase II and III trials (reviewed by Whitehead et al., 2009). A major advantage of employing the RNAi pathway is that genes can be silenced in non-model species, where reagents are limited but sequence information is available. This is particularly true for farm animals, where genome sequencing efforts have resulted in large sequence resources, but there are limited reagents, e.g. antibodies, available and few transgenic animals. Gene silencing by siRNA are now routinely used in studies on cattle (Ma and Corl, 2012), sheep (Smith et al., 2012), chickens (Qi et al., 2013), pigs (Shi et al., 2013) and salmon (Kumari et al., 2013) using cell lines and some primary cells. However, there are difficulties introducing exogenous nucleotides, including siRNA, into certain primary cells, especially primary macrophages (reviewed by Zhang et al., 2009) and studies using siRNA to investigate macrophage genes lag behind those for other cell types. There are several reasons for this difficulty, which relate to the function of macrophages. Macrophages play several important roles in the immune system. They detect pathogens and danger signals and respond by phagocytosis and destruction of pathogens, antigen presentation and the secretion of immunological mediators. For this they express many enzymes that can degrade nucleotides and are primed to react rapidly and vigorously to the presence of foreign particles. Our research focuses on investigating the role of bovine macrophages during infection with various pathogens, e.g. Theileria annulata (Jensen et al., 2009). As part of an on-going project we wished to investigate the functional importance of macrophage expressed genes by targeted silencing of genes in primary bovine monocyte-derived macrophages (bMDM). To our knowledge the use of siRNA or shRNA to knock-down gene expression in primary bovine macrophages has not been reported before. Therefore we set about investigating methods to silence bovine macrophage genes utilizing the RNAi pathway. Viral vectors, e.g. lentiviruses, can integrate into the genomes of non-dividing cells, resulting in constitutive expression of shRNA and long-term gene silencing (reviewed by Zhang et al., 2009) and lentiviruses have successfully transduced shRNA into primary human macrophages (Lee et al., 2003). However, one of the functions of macrophages is to respond to the presence of viruses, which may affect a subsequent response to challenge with the pathogen being investigated. Therefore, our efforts have concentrated on optimizing transient gene silencing in bMDM using the less immunogenic siRNA.
There are two predominant techniques that have been successfully used to introduce siRNA into primary macrophages derived from other, non-bovine species; transient transfection (Zhang et al., 2005, Wati et al., 2007, Behmoaras et al., 2008, Lietzen et al., 2011) and electroporation (Wiese et al., 2010). Transient transfection involves the use of cationic lipids which interact with negatively charged RNA or DNA and form lipoplexes by electrostatic forces (reviewed by Zuhorn et al., 2007) which are taken up by endocytosis. Electroporation involves the application of an external electric field which temporarily increases cell plasma permeability, causing pores to form in the plasma membrane through which RNA or DNA can directly enter cells (Neumann et al., 1982). Here we report our investigation of siRNA gene silencing in bovine bMDM and describe the optimization of siRNA delivery by transient transfection and electroporation.
- مقاله درمورد مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- بررسی های در مورد خاموش کردن ژن siRNA در bMDM گاوی گزارش و بهینه سازی تحویل siRNA از طریق انتقال موقت و الکتروپوریشن
- مقايسه تحويل RNA مضر (siRNA) به داخل ماکروفاژهای حاصل از مونوسیت گاوی توسط ترانسفکشن و الکتروپوراژ
- پروژه دانشجویی مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- مقايسه انتقال RNA کوتاه تداخلی با ماکروفاژهای حاصل از مونوسيت گاوی
- پایان نامه در مورد مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- تحقیق درباره مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- مقاله دانشجویی مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن در قالب پاياننامه
- پروپوزال در مورد مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- گزارش سمینار در مورد مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن
- گزارش کارورزی درباره مقايسه تحويل siRNA با ماکروفاژهای حاصل از مونوسیت گاوی توسط ترا آلایی و الکتروپوریشن